Ⅰ. Introduction
비알콜성 지방간질환 (Nonalcoholic fatty liver disease, NAFLD)은 간세포에 지방의 과도한 축적으로 유발되는 단순 지방증 (simple steatosis)부터 간세포의 염증 및 괴사, 섬유화를 나타나는 비알콜성 지방간염 (nonalcoholic steatohepatitis, NASH), 보다 진행된 간경변증까지 모두 포함하는 질환군이다1). 최근 한국인의 식생활이 서구화되면서 비만 증가율이 급격히 높아지고 있으며, 이에 따라 NAFLD의 유병율이 2004년 11.5%에서 2010년 23.6%로 2배 이상 증가하였다2) . 국내 비만 증가율이 급격히 높아지면서 2008년 소아 비만 혹은 과체중 유병률은 19%까지 보고되기도 했다3). 이러한 이유로 NAFLD의 유병률도 지속적으로 증가하고 있다4,5). NAFLD은 단순히 간 질환 정도에서 멈추지않고 인슐린 저항성을 유발하고 당뇨 및 대사증후군의 발병을 가능케하므로 적극적인 치료가 요구된다6).
현재 생활습관 교정과 식이요법 외에 표준화된 지방간 치료제는 없으며, 비알콜성 지방간 치료의 가장 중요한 부분은 체중감량이다. 3-5%의 체중 감소는 간내 지방 감소를 유발할 수 있으며, 지방간염환자 (NASH) 에서 간 내 염증을 호전시키려면 최소 10% 이상의 체중감량이 필요하다7). 그러나 연령이 증가할수록 체중감량이 어렵고, 지방간, 당뇨 환자 중에는 저체중인 경우도 많다. 따라서 지질 대사나 인슐린 저항성을 근본적으로 개선시킬 수 있는 치료약물이 필요하다. 최근 인슐린 저항성 개선 치료제로 Metformin이 많이 사용되고 있으나 간기능장애가 있을 때는 사용할 수 없는 단점이 있다8).
황련 (黃連)은 청열조습 (淸熱燥濕), 청열명목 (淸熱明目), 사화해독 (瀉火解毒)하는 효능이 있으며9), 주요성분인 berberine은 isoquinoline alkaloid 계열로 항암10-12), 항바이러스13), 항균14) 등의 효능이 있다. 감초 (甘草)는 감평무독 (甘平無毒)하여 청열해독 (淸熱解毒), 윤폐지해 (潤肺止咳), 보비익기 (補脾益氣)하는 효능이 있으며, 간염, 종양, 면역질환 등에 사용되었다15,16). 감초의 성분 중 glycyrrhizin, liquiritin, liquiritigenin, isoliquiritigenin 등은 항균효과가 있다17,18).
NAFLD에 대한 선행연구로 적소두19), 곤포20), 청간탕 (淸肝湯) 21), 인진22), 강지환 (降脂丸) 23), 가미소체환 (加味消滯丸) 23) 등을 이용한 실험에서 유효한 효과가 있음이 보고된 바 있다.
한의학적으로 NAFLD는 간에서 기혈순환이 문제가 생기면 습담이 생기고 비만이나 지방간 등의 질환을 일으키게 된다24). 따라서 한의학의 청열이습 (淸熱利濕)이 지방간 및 인슐린 저항성을 개선시킬 수 있을 것으로 생각되어 본 연구를 시작하게 되었다.
본 연구는 생쥐에게 20주 동안 고지방식이 섭취를 통해 NAFLD을 유발하면서 최종 8주 동안 황련-감초추출물을 투여하였다. 체중과 total cholesterol & glucose score를 측정하였고, sudan black B, PPARγ co-activator (PGC)-1를 통하여 지방대사 조절효과를 관찰하였다. 또한 phospho-IkB (p-IkB)를 통하여 항염증효과를 확인하고, phospho-c-Jun N-terminal kinase (p-JNK)을 측정하여 인슐린 저항성 조절효과를 알아보고자 하였다. 이 연구를 통해 황련-감초 추출물이 NAFLD을 유발한 생쥐에서 지방대사 조절을 통한 인슐린 저항성 완화효과를 확인하였기에 보고하는 바이다.
II. Materials & Methods
1. 실험동물
태령 6주 C57BL/6계 수컷 생쥐 (오리엔트, 한국)를 무균 사육장치 내에서 2주일 동안 적응시킨 후 체중 20 g 된 생쥐를 선별하여 사용하였다. 대조군 (Ctrl), 고지방식이 섭식군 (HFF), 고지방식이 섭식과 황련-감초추출물투여군 (CGT)으로 나누었다. 각 군에 10마리씩 배정하였으며, 실험 기간 20주 동안 high fat diet (fat, 60%; carbohydrate, 20%; protein, 20%; DIO DIET, USA)를 자유 섭식 시켰다. 동물실험은 세명대학교 동물실험윤리위원회의 승인 (smecae-2017-08-01) 후 실시되었고, 실험실 동물의 관리와 사용에 대해서는 NIH 가이드라인에 따라 시행되었다.
2. 추출물의 제조와 투여
황련 (Coptidis Rhizoma) 100 g과 감초 (Glycyrrhiza Uralensis) 100 g을 증류수 1000 ㎖에 넣고 3시간 동안 전탕한 후 여과하였다. 그 여액을 rotary evaporator를 이용하여 50 ㎖으로 감압․농축한 후 동결 건조하여 추출물 31 g (수득률 15.5%) 획득하였다. 획득된 황련-감초 혼합 추출물 (20 ㎎/㎏)을 생리식염수 (0.1 ㎖)에 녹인 후 최종 8주 동안 CGT에 고지방식이와 병행하여 경구투여 하였다.
3. 혈액 검사
혈액검사는 황련-감초추출물 투여 8주 후 심장 천자를 통해 얻어진 혈액으로 시행되었다. Total cholesterol은 혈청을 분리 후 Cholesterol E kit (BC 108-E, 영동제약, 한국)를 사용하여 측정하였다. 혈당은 채취된 혈액을 혈당계 (Freestyle, Therasence Inc, USA)를 통해 측정하였다.
4. DXA-Fat
sodium pentobarbital로 마취하고. x-ray absorptiometry (Inalyzer, Medikors, 한국)를 통해 지방분포를 분석하였다.
5. 조직화학
각 군을 경추 탈구로 희생시켜 간조직을 얻은 후 고정액인 10% Neutral buffered formalin 용액에 12시간 동안 처리하였다. 고정된 조직은 통상적인 방법으로 파라핀 (Sigma, USA)에 포매하여 5 ㎛ 두께의 연속절편으로 제작되었다.
지방화에 따른 간조직 내 형태변화 관찰을 위해 Masson trichrome 염색을 실시하였다. 우선 50-60 ℃ Bouin 용액에서 1시간 동안 매염 처리한 다음 70% 에탄올에서 picric acid를 제거하였다. Weigert iron hematoxylin에서 10분 동안 반응시켜 핵 염색하고, Biebrich scalet-acid fuchsin와 phosphomolybdic-phosphotungstic acid에서 각각 15분간, aniline blue에 5분간 처리하여 관찰하였다.
한편, 간조직 내 지방 관찰을 위한 조직화학에 필요한 냉동절편도 제작되었는데, 고정된 간조직을 10% formol-calcium에 1주일 동안 oxidation 처리하였다. Cryo-protection를 위해 30% sucrose 용액에 처리된 조직을 O.C.T. compound (Fisher, USA)에 포매한 후 냉동 절편기 (Microm, Germany)로 이용하여 10 ㎛ 두께의 냉동절편으로 제작하였다. 냉동절편을 Sudan Black B 염색을 한 후 지방분포 차이를 관찰·비교하였다.
6. 면역조직화학
지방대사 변화를 관찰하기 위해 PGC-1항체, 지방간에 따른 염증 변화를 관찰하기 위해 p-IkB항체를 이용하여 면역조직적 염색을 실시하였다. 그리고 지방화에 따른 인슐린 저항성 변화를 관찰하기 위해 p-JNK항체를 이용한 면역조직적 염색을 실시하였다. 간조직을 proteinase K (20 ㎍/㎖)에 5분 동안 proteolysis 과정을 거친 후 blocking serum인 10% normal goat serum에 4시간 동안 실온에서 반응시켰다. 이후 1차 항체인 mouse anti-PGC-1 (1:100, Santa Cruz Biotec, USA), mouse anti-p-IkB (1:250, Santa Cruz Biotec, USA), mouse anti-p-JNK (1:100, Santa Cruz Biotec, USA)에 4℃ humidified chamber에서 72시간 동안 반응시켰다. 그런 다음 2차 항체인 biotinylated goat anti-mouse IgG (1:100, Abcam, USA)에 4 ℃ humidified chamber에서 48시간 동안 반응 하였고, avidin biotin complex kit (Vector Lab, USA)를 이용하여 1시간동안 실온에서 반응시켰다. 0.05% 3,3'-diaminobenzidine과 0.01% HCl이 포함된 0.05 M tris-HCl 완충용액 (pH 7.4)에서 발색시킨 후, hematoxylin으로 대조염색하였다.
7. 영상처리 및 분석
조직화학과 면역조직화학의 결과는 image Pro Plus (Media cybernetics, USA)를 이용한 영상분석을 통해 수치화 (means ± standard error) 되었다. 각 군의 표본에서 임의로 선정된 간조직을 x100 배율에서 촬영한 다음 positive pixels /20,000,000 pixels로 영상 분석하였다.
8. 통계
본 실험 결과의 통계는 SPSS software (SPSS 23, SPSS Inc., USA)를 이루어졌으며, one-way ANOVA 시행을 통해 유의성 (p<0.05)을 검증하고 Tukey HSD로 사후 검증하였다.
III. Results
1. 체중 변화
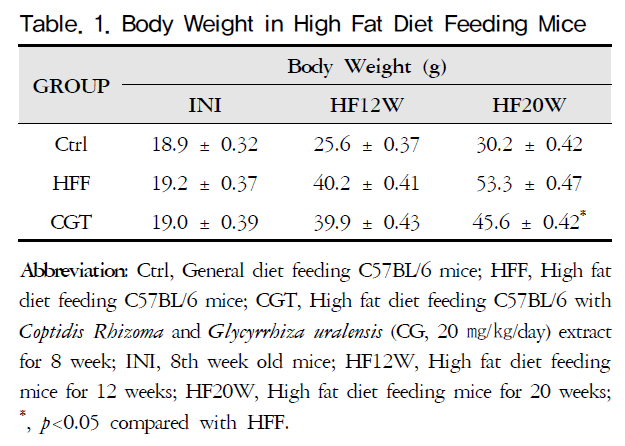
12주 동안 고지방식이가 섭식된 HFF (109%)와 CGT (110%)은 정상식이를 섭식한 Ctrl (35%)보다 큰 체중 증가를 보였다. 이후 8주 동안의 황련-감초추출물 투여는 체중 증가를 둔화시켰다. 8주 후 고지방식이만 섭식한 HFF의 체중은 33% 증가하였으나, CGT는 14% 증가하여 낮게 증가하였다 (p<0.05) (Table. 1).
Table. 1. Body Weight in High Fat Diet Feeding Mice
 2. 총콜레스테롤과 혈당 변화
2. 총콜레스테롤과 혈당 변화
혈청내 총콜레스테롤은 Ctrl (184 ± 5 ㎎/㎗)에 비해 HFF (643 ± 7 ㎎/㎗)은 249% 높았으며, CGT (406 ± 8 ㎎/㎗)도 증가하였으나 HFF 증가의 37% 로 유의성있게 낮았다 (p<0.05) (Fig. 1).
Fig. 1. Total cholesterol and glucose level of mice with nonalcoholic fatty liver disease (NAFLD)
혈당은 Ctrl (158 ± 5 ㎎/㎗)에 비해 HFF (484 ± 9㎎/㎗)은 206% 높았으며, CGT (312 ± 10 ㎎/㎗)에서 증가는 HFF 증가의 36%로 유의성 있게 낮았다 (p<0.05) (Fig. 1).
3. 체내 지방비율 변화
DXA로 체내 지방비율을 분석한 결과, Ctrl (26.7%)에 비해 HFF (54%)은 100% 높았으며, CGT (37%)는 HFF에 비해 31%의 유의성 있는 분포 감소를 보였다 (Fig. 2).
Fig. 2. Fat distribution of mice with nonalcoholic fatty liver disease (NAFLD). Abbreviation same as Fig. 1.
4. 지방축적 감소
20주 동안 고지방식이가 투여된 HFF에서 지방방울이 가득 찬 그물모양 (mesh-like type)의 세포질을 가진 지방축적 간세포들과 큰 지방방울 덩어리가 세포질에 찬 지방축적 간세포들이 간조직에서 다수로 관찰되었다. 8주 동안 방풍통성산 추출물이 투여된 CGT에서는 HFF에 비해 적은 수의 지방축적 간세포가 중심정맥 (central vein)과 문맥 (portal vein)의 사이 중간에서만 관찰되었다 (Fig. 3).
Fig. 3. Lipid deposition of mice with nonalcoholic fatty liver disease (NAFLD).
간조직 내 지방방울 (lipid blot)의 분포변화는 sudan black B 염색을 통해서 조사되었는데, HFF의 간조직에서는 검고 진하게 염색된 다양한 크기의 지방방울을 포함하고 있는 간세포가 다수 관찰되었다. 이에 반해 CGT은 옅게 염색된 작은 지방방울이 축적된 간세포가 관찰되었고, 관찰 지역은 중심정맥과 문맥사이였다. 이러한 경향은 영상분석을 통해 확인하였으며, Ctrl (22,004 ± 947/20,000,000 pixel)에 비해 HFF (127,340 ± 2,699 /20,000,000 pixel)은 지방방울이 479% 증가되어 있었다. CGT (80,457 ± 2,759/20,000,000 pixel)은 HFF에 비해 지방방울 분포가 37% 적었다 (Fig. 3).
PCG-1 양성반응은 지방축적 간세포의 핵과 핵막에서 강한 양성으로 관찰되었다. HFF의 간조직에서는 PGC-1 양성반응 (108,995 ± 2,405/20,000,000 pixel)이 Ctrl (7,193 ± 261/20,000,000 pixel)에 비해 1,415% 증가하였다. 반면 CGT (65,239 ± 1,707/20,000,000 pixel)은 HFF보다 40% 적었다 (Fig. 3).
5. 염증 조절
p-IkB 양성반응은 중심정맥과 문맥주변에 분포하는 그물모양 세포질을 가진 지방축적간세포의 핵과 핵막에서 강한 양성으로 관찰되었다. HFF의 간조직에서는 p-IkB 양성반응 (108,501 ± 2,143/20,000,000 pixel)이 Ctrl (12,030 ± 337/20,000,000 pixel)에 비해 982% 증가하였다. 이에 반해 CGT (49,774 ± 1,322/20,000,000 pixel)은 HFF보다 54% 유의성 있게 낮은 증가를 보였다 (Fig. 4).
Fig. 4. The decrease of inflammation (p-IkB immunohistochemistry) in hepatic tissue of mice with nonalcoholic fatty liver disease (NAFLD) by CG
6. 인슐린저항성 조절
p-JNK 양성반응은 중심정맥과 문맥사이에 분포하는 지방축적간세포들의 세포질에서 강한 양성으로 관찰되었다. HFF의 간조직에서는 p-JNK 양성반응 (102,620 ± 2,270/20,000,000 pixel)이 Ctrl (8,453 ± 477/20,000,000 pixel)에 비해 1,114% 증가하였다. CGT (57,445 ± 2,645/20,000,000 pixel)은 HFF보다 44% 유의성 있게 낮은 증가를 보였다 (Fig. 5).
Fig. 5. The alleviation of insulin resistance in hepatic tissue of mice with nonalcoholic fatty liver disease (NAFLD) by CG (p-JNK immunohistochemistry)
Ⅳ. Discussion
NAFLD의 유병률은 전 세계에서 증가하고 있으며, 이러한 유병률의 증가는 비만과 관련이 높으며, 선진국에서는 전체 인구의 약 20~30%로 보고되고 있다25). 유병률이 높은 NAFLD 환자의 다수는 섬유화가 없는 단순 지방간으로 임상 경과가 양호하다26). 하지만 NAFLD 환자 중 약 10~20%에서 NASH가 발생하며 이 NASH 환자 중 약 9~25%에서 간경변증으로 진행된다27-29). 간경변증이 되면 간세포 암의 발생 가능성이 증가하게 되고, 10년 이상 경과하면 이 중 30~40%는 간질환의 합병증으로 사망하게 된다.
한의학에서 간은 소설 (疏泄)기능을 통해 인체의 기혈을 소통시키며, 이러한 기능이 떨어지면 지방에 해당되는 습담 (濕痰)이 쌓여 비만 및 지방간을 일으키게 된다고 인식하였다. 특히 간신동원 (肝腎同源)이라 하여 간의 기운이 울체되어 화 (火)를 생성하면 신음 (腎陰)이 마르게 되어 소갈, 즉 당뇨나 황달이 잘 생긴다고 하여 지방간과 당뇨와의 관련성을 제시하고 있다30). 이러한 이론적 근거를 토대로 간에 습담이 쌓이면 습열 (濕熱)로 질병을 유발하므로 한의학의 청열이습법 (淸熱利濕法)이 지방간 및 인슐린 저항성을 개선시킬 수 있을 것으로 생각된다.
본 연구에서는 황련-감초 추출물의 지방대사 조절을 통하여 비알콜성 지방간질환으로 유도된 인슐린 저항성에 대한 개선효과를 알아보고자 하였다.
본 연구에서는 먼저 황련-감초 추출물이 체중조절에 영향을 줄 수 있는지 확인하고자 체중을 측정하여 비교하였다. 12주 동안 고지방식이가 섭식된 HFF, CGT가 정상식이를 섭식한 Ctrl보다 큰 체중 증가를 보였으나, 최종 8주 동안 황련-감초 추출물을 투여한 CGT은 HFF에 비해 체중 증가가 급격하게 둔화되었다. 이는 황련-감초 추출물이 과도한 지방식이 섭취로 인한 체중의 급격한 증가를 완화시킬 수 있음을 의미한다. 이러한 결과는 황련-감초 추출물이 지방대사 조절에 효과가 있을 가능성을 제시한다.
이러한 내용은 혈청 total cholesterol와 혈당 수치를 통하여 다시 확인할 수 있었다. 혈청 total cholesterol은 Ctrl에 비해 HFF, CGT 모두 증가하였으나, CGT는 HFF 증가의 37% 로 유의성 있게 낮았다 (p<0.05). 이 혈액학적 연구결과는 황련-감초 추출물이 간조직 내에서 지방 대사 조절에 관여하고 있음을 분명하게 보여준다.
비만과 인슐린저항성이 있는 경우 간으로 유리지방산 (free fatty acid, FFA)의 유입이 증가되며, FFA는 베타산화과정 (β-oxidation)나 중성지방 (triglyceride, TG)의 에스테르화를 통해 간에서 지방이 쌓이게 된다31). 본 연구에서는 DXA로 체내 지방비율을 분석한 결과, Ctrl에 비해 HFF은 100% 높았으며, CGT는 HFF에 비해 31%의 유의성 있는 분포 감소를 보였다. 지방축적 간세포에서는 20주 동안 고지방식이가 투여된 HFF에서 지방방울이 가득 찬 그물모양 (mesh-like type)의 세포질을 가진 지방축적 간세포들과 큰 지방방울 덩어리가 세포질에 찬 지방축적 간세포들이 많았다. 이에 비해 CGT에서는 HFF에 비해 적은 수의 지방축적 간세포가 중심정맥과 문맥의 사이에서 관찰되었다. 또한 sudan black B 염색을 통하여 HFF에서는 검고 진하게 염색된 다양한 크기의 지방방울 분포를 포함하고 있는 간세포를 관찰하였으나, CGT은 옅게 염색된 작은 지방방울이 축적된 간세포가 관찰되었다. Ctrl에 비해 HFF은 지방방울이 높게 증가하였으나, CGT은 HFF에 비해 적었다. 지방대사에 관여하는 PGC-1 발현 역시 HFF의 간 조직에서는 Ctrl에 비해 높게 증가하였다. 간에서 지방이 쌓이면 PGC-1 발현이 증가하고, 이로 인해 Acetyl CoA carboxylase-1 (ACC)와 Fatty acid synthase (FAS) 유전자 발현이 촉진되고, Glucose의 Acetyl-CoA로의 전환이 증가되어 간에서 지방축적이 가속화된다31). 과도한 FFA로 산화스트레스가 증가하고 염증이 생겨 간 손상이 발생하고, 이를 막고자 간 내 TG가 축적되게 된다32,33). 최종적으로는 간섬유화와 질병의 진행을 유발하게 된다34). 이에 비해 황련-감초 추출물을 투여한 CGT에서는 HFF보다 40% 적었다. 이러한 조직학적, 면역조직학적 결과는 황련-감초 추출물이 간 조직 내 지방대사 조절에 관여하고 있음을 의미한다
또한 간에서 지방축적이 과도하면 염증이 발생하는데, 이는 지방간에서 지방간염으로의 이행을 의미한다35). 염증이 생기면 비만세포와 대식세포에서 nuclear factor (NF)-κB, nitric oxide 같은 물질들을 분비하게 된다. NF-κB는 염증 반응에 주요한 전사인자로, pro-inflammtory mediators의 유전자 발현 조절을 통하여 hypoxia-inducible factor (HIF)-1이나 cyclooxygenase (COX)-2를 조절하며, 혈관 투과성 증가, 부종 등의 염증반응을 촉진한다36,37). 이때 iNOS의 발현은 염증효소 전사인자인 NF-kB에 의해 조절되며, inhibitor of NF-kB (IkB)의 인산화 (phosphorylation)가 증가하여 NF-kB의 핵 내로 들어가 NF-κB binding site에 결합하여 염증관련 유전자의 발현을 유도한다38). 본 연구에서는 황련-감초 추출물이 NF-kB의 활성조절에 영향을 주는지 확인하고자 p-IkB 양성반응을 조사하였다 p-IkB 양성반응은 중심정맥과 문맥 주변에 분포하는 지방축적 간세포의 핵과 핵막에서 관찰되었다. HFF에서는 p-IkB 양성반응이 Ctrl에 비해 높게 증가하였다. 이에 비해 황련-감초추출물을 투여한 CGT에서는 HFF보다 54% 낮게 관찰되었다. 이러한 결과는 황련-감초 추출물 투여가 간 내 염증발현을 감소시킬 수 있는 가능성을 보여준다. 또한 간에서 지방축적이 과도하여 지방간염으로 진행되는 것을 줄여줄 수 있음을 의미한다.
임상적으로 NAFLD와 당뇨병, 비만, 고혈압, 고지혈증 등의 대사증후군은 연관이 많다. 대사증후군은 특징적으로 인슐린 저항성을 가지며, NAFLD에서도 대부분 인슐린 저항성이 증가되어 있다35). 인슐린 저항성에 관여하는 p-JNK는 중심정맥과 문맥사이에 분포하는 지방축적 간세포들의 세포질에서 관찰되었다. HFF에서는 p-JNK 양성반응이 Ctrl에 비해 높게 증가하였다. 이에 비해 CGT은 HFF보다 44% 적었다
오늘날 사용 중인 인슐린 저항성 치료제인 Metformin은 위장관계 부작용이 있고 간 질환에는 사용이 어렵다8). Thiazolidinedione은 간 손상의 부작용이 보고되어져 있다. 이러한 부작용은 인슐린저항성 개선을 통해 NAFLD을 예방하는 것을 어렵게 하고 있다39,40). 본 연구의 결과는 황련-감초 추출물이 기존 치료제의 부작용 문제를 해결할 수 있는 새로운 인슐린 저항성 치료제로서 가능성이 있음을 보여준다.
본 연구는 이러한 연구 결과를 토대로 황련-감초 추출물이 지방대사 조절을 통하여 비알콜성 지방간증을 완화시키는 효과가 있으며, 비알콜성 지방간으로 인하여 유도된 인슐린 저항성을 개선시키는 효과가 있음을 확인하였다. 또한 이러한 결과는 소아과 영역에서 볼 때, 증가하는 소아 비만 및 소아 당뇨 같은 소아 대사성 질환에 대한 치료제 개발의 가능성을 제시하고 있다. 향후 후속연구로 현재 사용 중인 Metformin과의 비교연구를 통해 황련-감초 추출물의 치료제로서의 실질적 가능성을 확인하는 것이 필요할 것으로 생각된다.
V. Conclusion
황련-감초 추출물의 지방대사조절을 통한 비알콜성 지방간 개선 효과를 확인하기 위해 본 연구는 생쥐에게 20주 동안 고지방식이를 섭식시킨 후 황련-감초 추출물을 투여하여 생쥐의 체중변화, 지방방울 분포, PGC-1 양성반응, p-IkB 양성반응, p-JNK 양성반응, Total cholesterol & Glucose score 변화를 통해 다음과 같은 결과를 얻었다.
1. 체중 측정 결과 황련-감초 추출물을 투여한 고지방식이 섭식군이 단순 고지방식이 섭식군에 비해 체중증가가 유의하게 감소되었다.
2. 지방방울 분포 및 PGC-1 양성반응은 황련-감초추출물 투여군에서 증가가 유의하게 감소되었다.
3. 간조직의 p-IκB, 8-OHdG 양성반응은 황련-감초추출물 투여군에서 증가가 유의하게 감소되었다.
4. 간조직의 p-JNK 양성반응은 황련-감초 추출물 투여군에서 증가가 유의하게 감소되었다.
5. Total cholesterol 및 Glucose 수치는 황련-감초 추출물 투여군에서 증가가 유의하게 감소되었다.
Acknowledgemen
이 논문은 2018학년도 세명대학교 교내학술연구비 지원에 의해 수행된 연구임
References
- Clark JM. The epidemiology of nonalcoholic fatty liver disease in adults. J Clin Gastroenterol. 2006;40 Suppl 1:S5-10.
- Korea Food & Drug Administration. The press release. Retrieved Nov. 14, 2013. Available from http://www.mfds.go.kr/index.do?mid=675&seq=19618&cmd=v
- Oh K, Jang MJ, Lee NY, Moon JS, Lee CG, Yoo MH. Prevalence and trends in obesity among Korean children and adolescents in 1997 and 2005. Korean J Pediatr. 2008;51:950-5. https://doi.org/10.3345/kjp.2008.51.9.950
- Bellentani S, Scaglioni F, Marino M, Bedogni G. Epidemiology of non-alcoholic fatty liver disease. Dig Dis. 2010;28:155-61. https://doi.org/10.1159/000282080
- Barshop NJ, Sirlin CB, Schwimmer JB, Lavine JE. Review article epidemiology, pathogenesis and potential treatments of paediatric non-alcoholic fatty liver disease. Aliment Pharmacol Ther. 2008;28:13-24. https://doi.org/10.1111/j.1365-2036.2008.03703.x
- Ahn YJ, Yoon KH, Jo JH, Jang DH, Jung YS, Kim JH, Kim BC, Seok HJ, Yoo JS, Ku JR, Yoon M, Shin SS. Gangjihwan Improves nonalcoholic fatty liver disease in high fat diet-fed C57BL/6N mice. Kor. J. Herbology. 2014;29(2):47-54. https://doi.org/10.6116/kjh.2014.29.2.47
- Lee BW. Management of patients with nonalcoholic fatty liver disease with lifestyle modification. Korean Diabetes. 2018;19:82-7. https://doi.org/10.4093/jkd.2018.19.2.82
- Cone CJ, Bachyrycz AM, Murata GH. Hepatotoxicity associated with metformin therapy in treatment of type 2 diabetes mellitus with nonalcoholic fatty liver disease. Ann Pharmacother. 2010;44(10):1655-9. https://doi.org/10.1345/aph.1P099
- Tang J, Feng YB, Tsao S, Wang N, Curtain R, Wang YW. Berberine and coptidis rhizoma as novel antineoplastic agents: A review of traditional use and biomedical investigations. J Ethnopharmacol. 2009;126(1):5-17. https://doi.org/10.1016/j.jep.2009.08.009
- Jabbarzadeh Kaboli P, Rahmat A, Ismail P, Ling KH. Targets and mechanisms of berberine, a natural drug with potential to treat cancer with special focus on breast cancer. Eur J Pharmacol. 2014;740:584-95. https://doi.org/10.1016/j.ejphar.2014.06.025
- Ortiz LM, Lombardi P, Tillhon M, Scovassi AI. Berberine, an epiphany against cancer. Molecules. 2014;19(8):12349-67. https://doi.org/10.3390/molecules190812349
- Yu M, Tong X, Qi B, Qu H, Dong S, Yu B. Berberine enhances chemosensitivity to irinotecan in colon cancer via inhibition of NFkappaB. Molecular medicine reports. 2014;9(1):249-54. https://doi.org/10.3892/mmr.2013.1762
- Chin LW, Cheng YW, Lin SS, Lai YY, Lin LY, Chou MY, et al. Anti-herpes simplex virus effects of berberine from coptidis rhizoma, a major component of a Chinese herbal medicine, Ching-Wei-San. Arch Virol. 2010;155 (12):1933-41. https://doi.org/10.1007/s00705-010-0779-9
- Yu YE, Park EY, Jung DH, Byun SH, Kim SC, Park SM. Antibacterial activity of oriental medicinal herb extracts against skin pathogens. Journal of Life Science. 2010;20(7):1143-50. https://doi.org/10.5352/JLS.2010.20.7.1143
- Miao KL, Zhang JZ, Dong Y, Xi YF. Research progress on the chemical compounds and pharmacology of Sophora flavescens. Natural Product Research Development. 2001;13:69-73. https://doi.org/10.3969/j.issn.1001-6880.2001.02.021
- Kusano G, Shibano M, Watanabe H. Pharmaceutical botanical studies on some Glycyrrhiza species. Yakugaku Zasshi. 2003;123:619-31. https://doi.org/10.1248/yakushi.123.619
- Kim HJ, Bae JY, Jang HN, Park SN. Comparative study on antimicrobial activity of glycyrrhiza uralensis and glycyrrhiza glabra extracts in various country of origin as natural antiseptics. Kor J Microbiol Biotechnol. 2013;41(3):358-66. https://doi.org/10.4014/kjmb.1307.07003
- Kim HJ, Jang HN, Bae JY, Ha JH, Park SN. Antimicrobial activity, quantification and bactericidal activities of licorice active ingredients. Kor J Microbiol Biotechnol. 2014;42(2):386-92. https://doi.org/10.4014/kjmb.1410.10002
- Jang YS, Seo JY, kwun MJ, Kwon JN, Lee I, Hong JW, Kim SY, Choi JY, Park SH, Joo M, Han CW. Effect of phaseolus angularis seed on experimental cellular model of nonalcoholic fatty liver disease. Korean J. Oriental Physiology & Pathology. 2013;27(6):802-8.
- Kim SY, Kwon JN, Lee I, Hong JW, Choi JY, Park SH, Kwon MJ, Joo M, Han CW. Research on anti-lipogenic effect and underlying mechanism of laminaria japonica on experimental cellular model of non-alcoholic fatty liver disease. J. Int. Korean Med. 2014:35(2)175-83.
- Han CW, Lee JH. Effects of KHchunggan-tang on the nonalcoholic fatty liver disease in palmitate-induced cellular model. J Korean Oriental Med. 2011;32(1):109-20.
- Kim K, Ko H, Shin S. Diagnostic process analysis of prescribing injinho-tang in non alcohoic fatty liver disease using by AHP. The Journal of the Society of Korean Medicine Diagnostics. 2015;19(3):159-71.
- Jung YS, Kim JH, Kim BC, Seok HJ, Yoo JS, Ku JR, Yoon KH, Jo JH, Jang DH, Yun HY, Yoon M, Shin SS. Comparison of gangjihwan-1,2,3,4 and combination of gangjihwan-1 and gamisochehwan in the improvement effects of nonalcoholic fatty liver disease in a high fat diet-fed obese mouse model. Kor. J. Herbology. 2014;29(6):149-56. https://doi.org/10.6116/kjh.2014.29.6.149.
- Seo IB, Ahn SH, Kim KB. The effect of bangpungtongsungsan on insulin resistance induced by non-alcoholic fatty liver disease (NAFLD). J Pediatr Korean Med. 2018;32(4):1-12. https://doi.org/10.7778/JPKM.2018.32.4.001
- Browning JD, Szczepaniak LS, Dobbins R, Nuremberg P, Horton JD, Cohen JC, Grundy SM, Hobbs HH. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity. Hepatology. 2004;40:1387-95. https://doi.org/10.1002/hep.20466
- Day CP. Natural history of NAFLD: remarkably benign in the absence of cirrhosis. Gastroenterology. 2005;129:375-8. https://doi.org/10.1053/j.gastro.2005.05.041
- Ekstedt M, Franzen LE, Mathiesen UL, Thorelius L, Holmqvist M, Bodemar G, Kechagias S. Long-term follow-up of patients with NAFLD and elevated liver enzymes. Hepatology. 2006;44:865-73. https://doi.org/10.1002/hep.21327
- Fassio E, Alvarez E, Dominguez N, Landeira G, Longo C. Natural history of nonalcoholic steatohepatitis: a longitudinal study of repeat liver biopsies. Hepatology. 2004;40:820-6. https://doi.org/10.1002/hep.1840400411
- Adams LA, Lymp JF, St Sauver J, Sanderson SO, Lindor KD, Feldstein A, Angulo P. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology. 2005;129:113-24. https://doi.org/10.1053/j.gastro.2005.04.014
- Son CK. The research of immunological function in liver. J Korean Oriental Med. 2001;22(1):3-9.
- Park MJ, Kim DI, Lim SK, Choi JH, Kim JC, Yoon KC, Lee JB, Lee JH, Han HJ, Choi IP, Kim HC, Park SH. Thioredoxin-interacting protein mediates hepatic lipogenesis and inflammation via PRMT1 and PGC-1a regulation in vitro and in vivo. Journal of Hepatology. 2014;61:1151-7. https://doi.org/10.1016/j.jhep.2014.06.032
- Yamaguchi K, Yang L, McCall S, Huang J, Yu XX, Pandey SK, Bhanot S, Monia BP, Li YX, Diehl AM. Inhibiting triglyceride synthesis improves hepatic steatosis but exacerbates liver damage and fibrosis in obese mice with nonalcoholic steatohepatitis. Hepatology. 2007;45:1366-74. https://doi.org/10.1002/hep.21655
- Feldstein AE, Werneburg NW, Canbay A, Guicciardi ME, Bronk SF, Rydzewski R, Burgart LJ, Gores GJ. Free fatty acids promote hepatic lipotoxicity by stimulating TNF-alpha expression via a lysosomal pathway. Hepatology. 2004;40:185-94. https://doi.org/10.1002/hep.20283
- Jou J, Choi SS, Diehl AM. Mechanisms of disease progression in nonalcoholic fatty liver disease. Semin Liver Dis. 2008;28:370-9. https://doi.org/10.1055/s-0028-1091981
- Kim TH. Obesity and fatty liver disease. Korean Journal of Medcine. 2005;68(4):347-50.
- Jung YJ, Isaacs JS, Lee S, Trepel J, Neckers L. IL-1beta-mediated up-regulation of HIF-1alpha via an NFkappaB/COX-2 pathway identifies HIF-1 as a critical link between inflammation and oncogenesis. FASEB J. 2003;17(14):2115-7. https://doi.org/10.1096/fj.03-0329fje
- Cha HY, Ahn SH, Cheon JH, Park IS, Kim JT, Kim KB. Hataedock treatment has preventive therapeutic effects in atopic dermatitis-induced NC/Nga mice under high-fat diet conditions. Evid Based Complement Alternat Med. 2016:1-13.
-
Baeuerle PA, Baltimore D. NF-
${\kappa}B$ - Ten years after. Cell. 1996;87:13-20. https://doi.org/10.1016/S0092-8674(00)81318-5 - Lipscombe LL, Gomes T, Levesque LE, Hux JE, Juurlink DN, Alter DA. Thiazolidinediones and cardiovascular outcomes in older patients with diabetes. JAMA. 2007;298:2634-43. https://doi.org/10.1001/jama.298.22.2634
- Lincoff AM, Wolski K, Nicholls SJ, Nissen SE. Pioglitazone and risk of cardiovascular events in patients with type 2 diabetes mellitus: a meta-analysis of randomized trials. JAMA. 2007;298:1180-8. https://doi.org/10.1001/jama.298.10.1180